
GMP驗證對臭氧滅菌要求
藥品生產質量管理規范(GMP)于1962年首先在美國施行。我國于1988年由衛生部正式頒發了我國的GMP,這是我國藥品生產企業管理生產和質量的基本法規,今后凡是沒有通過GMP驗證的藥品生產企業,就不能進行藥品生產。所以GMP驗證工作受到了藥品生產企業的高度重視,在我國的GMP中臭氧滅菌方法是被推薦的滅菌方法之一,給臭氧滅菌的應用帶來了前所末有的機遇。
眾所周知,藥品是用來治病的,因此,它對藥檢的要求很嚴。表一是GMP驗證中規定的藥品微生物檢查要求。
表一: 藥品的微生物檢查要求
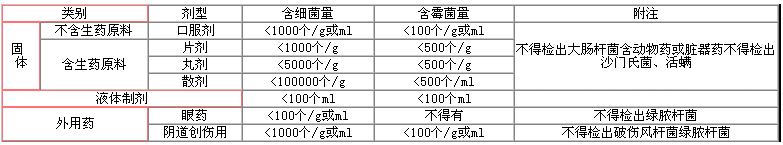
為了做到藥品的菌檢合格,那么,首先要求藥品生產的環境是合格的。在制藥廠,生產車間(潔凈區)劃分為不同的級別。表二是GMP驗證規定的潔凈級別的要求。

表二: 潔凈級別要求
對不同潔凈級別的潔凈室,細菌的允許值如表三所示:

表三: 細菌允許值
為了使潔凈室達到上述要求,選擇什么樣的凈化滅菌工藝,就至關重要。在我國的GMP驗證中,介紹了四種滅菌方法,臭氧滅菌就是其中之一。但無論用什么消毒方法,都要達到上述規定,當然臭氧也不列外。而且,臭氧作為一種取代傳統消毒方法的消毒手段,人們對它的要求更高更嚴,而且要更省事,否則,就難以立足。所以說,GMP驗證對臭氧滅菌提出了嚴格的要求。








電話
微信客服
